
Chất khí (tiếng Anh: Gas) là tập hợp các nguyên tử hay phân tử hay các hạt nói chung trong đó các hạt có thể tự do chuyển động trong không gian. Lực tương tác giữa các hạt rất yếu, và các hạt chủ yếu tương tác với nhau qua va chạm ngẫu nhiên, hoặc với thành chứa. Các hạt chuyển động với tốc độ và hướng ngẫu nhiên, và các vận tốc của các hạt chỉ thay đổi đáng kể thông qua các va chạm ngẫu nhiên với nhau hoặc với thành vật chứa.
Các chất khí trong cuộc sống thường được coi là một trong bốn trạng thái vật chất quan trọng nhất. Các trạng thái kia là chất rắn, chất lỏng và plasma. Các chất thông thường thường tồn tại ở trạng thái rắn ở nhiệt độ thấp, chuyển sang trạng thái lỏng ở nhiệt độ cao hơn (thông qua hiện tượng nóng chảy), rồi sang trạng thái khí khi nhiệt độ được tiếp tục nâng lên (hiện tượng bay hơi), và cuối cùng là sang trạng thái plasma ở nhiệt độ đủ cao. Cũng có những chất có thể chuyển ngay từ trạng thái rắn sang trạng thái khí ở điều kiện thích hợp (hiện tượng thăng hoa). Mặc dù chuyển động của các hạt trong chất khí là ngẫu nhiên, vận tốc của chúng có thể được mô tả theo thống kê bằng các phân bố như phân bố Maxwell-Boltzmann, phân bố Fermi hay phân bố Bose. Các phân bố này cho thấy sự phụ thuộc của dải biến đổi của vận tốc, cũng như vận tốc trung bình, vào nhiệt độ. Nhiệt độ càng cao thì vận tốc trung bình của các hạt càng tăng và ngược lại.
Trạng thái khí của vật chất xảy ra giữa trạng thái chất lỏng và plasma,[1] trạng thái sau của nó cung cấp ranh giới nhiệt độ trên cho chất khí. Giới hạn đầu dưới của thang nhiệt độ là các khí lượng tử suy biến [2] đang ngày càng được chú ý.[3] Các khí nguyên tử mật độ cao được làm lạnh siêu tốc đến nhiệt độ rất thấp được phân loại theo hành vi thống kê của chúng là khí Bose hoặc khí Fermi. Để có danh sách toàn diện về các trạng thái vật chất kỳ lạ này, hãy xem danh sách các trạng thái của vật chất.
Chất khí nguyên tố
Các nguyên tố hóa học mà là các phân tử gồm 2 nguyên tử tại nhiệt độ và áp suất tiêu chuẩn là hydro (H2), nitơ (N2), oxy (O2), và hai halogen: flo (F2) và clo (Cl2). Khi được nhóm cùng với các khí cao nguyên tố – helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) và radon (Rn) – những khí này được gọi là các "chất khí nguyên tố".
Tính chất vật lý

Bởi vì hầu hết các chất khí rất khó quan sát trực tiếp, chúng được mô tả thông qua việc sử dụng bốn tính chất vật lý hoặc đặc điểm vĩ mô: áp suất, thể tích, số lượng các hạt (các nhà hóa học phân nhóm chúng theo mol) và nhiệt độ. Bốn đặc điểm này đã được các nhà khoa học như Robert Boyle, Jacques Charles, John Dalton, Joseph Gay-Lussac và Amedeo Avogadro quan sát nhiều lần đối với nhiều loại khí trong các môi trường khác nhau. Các nghiên cứu chi tiết của họ cuối cùng đã dẫn đến mối quan hệ toán học giữa các tính chất này được biểu thị bằng định luật khí lý tưởng (xem phần mô hình đơn giản bên dưới).
Các hạt khí được phân tách rộng rãi với nhau, và do đó, có liên kết giữa các phân tử yếu hơn chất lỏng hoặc chất rắn. Các lực liên phân tử này là kết quả của tương tác tĩnh điện giữa các hạt khí. Các vùng tích điện giống nhau của các hạt khí khác nhau đẩy lùi, trong khi các vùng tích điện trái dấu của các hạt khí khác nhau hút nhau; khí có chứa các ion tích điện vĩnh viễn được gọi là plasma. Các hợp chất khí có liên kết cộng hóa trị phân cực chứa sự mất cân bằng điện tích vĩnh viễn và do đó chịu lực tương đối mạnh giữa các phân tử, mặc dù phân tử trong khi điện tích thực của hợp chất vẫn trung tính. Các điện tích cảm ứng ngẫu nhiên, thoáng qua tồn tại trên các liên kết cộng hóa trị không phân cực của các phân tử và tương tác tĩnh điện do chúng gây ra được gọi là lực Van der Waals. Tương tác của các lực giữa các phân tử này khác nhau trong một chất, điều này quyết định nhiều tính chất vật lý riêng của mỗi chất khí.[4][5] So sánh điểm sôi của các hợp chất được tạo thành bởi liên kết ion và cộng hóa trị dẫn chúng ta đến kết luận này.[6] Các hạt khói trôi dạt trong ảnh cung cấp một số thông tin chi tiết về hành vi của khí trong áp suất thấp.
So với các trạng thái khác của vật chất, các loại khí có mật độ và độ nhớt thấp. Áp suất và nhiệt độ ảnh hưởng đến các hạt trong một thể tích nhất định. Sự thay đổi về tốc độ và phân tách hạt này được gọi là khả năng nén. Sự phân tách và kích thước hạt này ảnh hưởng đến các đặc tính quang học của khí như có thể tìm thấy trong danh sách các chỉ số khúc xạ sau đây. Cuối cùng, các hạt khí phân tán hoặc khuếch tán để tự phân bố đồng nhất trong bất kỳ bình chứa nào.
Quy mô vĩ mô

Khi quan sát một chất khí, điển hình là xác định hệ quy chiếu hoặc thang độ dài. Thang độ dài lớn hơn tương ứng với quan điểm vĩ mô hoặc toàn cục của chất khí. Vùng này (gọi là thể tích) phải có kích thước đủ để chứa một lượng lớn các hạt khí lấy mẫu. Kết quả phân tích thống kê của cỡ mẫu này tạo ra hành vi "trung bình" (tức là vận tốc, nhiệt độ hoặc áp suất) của tất cả các hạt khí trong vùng. Ngược lại, thang độ dài nhỏ hơn tương ứng với quan điểm vi mô hoặc hạt.
Về mặt vĩ mô, các đặc tính khí đo được là về bản thân các hạt khí (vận tốc, áp suất hoặc nhiệt độ) hoặc môi trường xung quanh chúng (thể tích). Ví dụ, Robert Boyle đã nghiên cứu hóa học khí nén trong một phần nhỏ sự nghiệp của mình. Một trong những thí nghiệm của ông liên quan đến các tính chất vĩ mô của áp suất và thể tích của một chất khí. Thí nghiệm của ông đã sử dụng một áp kế ống chữ J trông giống như một ống nghiệm hình chữ J. Boyle đã nhốt một khí trơ vào đầu kín của ống nghiệm bằng một cột thủy ngân, từ đó tạo ra số lượng các hạt và nhiệt độ không thay đổi. Ông quan sát thấy rằng khi tăng áp suất trong chất khí, bằng cách đổ thêm thủy ngân vào cột, thì thể tích của chất khí bị mắc kẹt giảm xuống (điều này được gọi là mối quan hệ nghịch đảo). Hơn nữa, khi Boyle nhân áp suất và thể tích của mỗi lần quan sát, sản phẩm là không đổi. Mối quan hệ này phù hợp với mọi khí mà Boyle quan sát được dẫn đến định luật, (PV = k), được đặt tên theo tên của Boyle để tôn vinh các nghiên cứu của ông trong lĩnh vực này.
Có rất nhiều công cụ toán học có sẵn để phân tích các tính chất của khí. Khi các chất khí phải chịu các điều kiện khắc nghiệt, các công cụ này trở nên phức tạp hơn, từ các phương trình Euler cho dòng không thẩm thấu đến các phương trình Navier – Stokes [7] đến đầy đủ các hiệu ứng nhớt. Các phương trình này được điều chỉnh phù hợp với các điều kiện của hệ thống khí được đề cập. Thiết bị phòng thí nghiệm của Boyle cho phép sử dụng đại số để thu được kết quả phân tích của ông. Kết quả của ông có thể thực hiện được vì ông đang nghiên cứu các chất khí trong các tình huống áp suất tương đối thấp, nơi chúng hoạt động theo cách "lý tưởng". Những mối quan hệ lý tưởng này áp dụng cho các tính toán an toàn cho nhiều điều kiện bay khác nhau trên các vật liệu được sử dụng. Thiết bị công nghệ cao đang được sử dụng ngày nay được thiết kế để giúp chúng ta khám phá một cách an toàn các môi trường hoạt động kỳ lạ hơn, nơi các khí không còn hoạt động theo cách "lý tưởng". Toán học nâng cao này, bao gồm thống kê và phép tính đa biến, có thể đưa ra giải pháp cho các tình huống động phức tạp như việc đi lại xe không gian. Một ví dụ là phân tích hình ảnh quay lại tàu con thoi để đảm bảo các đặc tính vật liệu trong điều kiện tải này là phù hợp. Trong chế độ bay này, khí không còn hoạt động lý tưởng nữa.
Áp suất
Ký hiệu được sử dụng để biểu diễn áp suất trong phương trình là "p" hoặc "P" với đơn vị SI là pascal.
Khi mô tả một bình chứa khí, thuật ngữ áp suất (hoặc áp suất tuyệt đối) dùng để chỉ lực trung bình trên một đơn vị diện tích mà khí tác dụng lên bề mặt của bình chứa. Trong phạm vi thể tích này, đôi khi dễ dàng hình dung các hạt khí chuyển động theo đường thẳng cho đến khi chúng va chạm với bình chứa (xem sơ đồ ở đầu bài viết). Lực do một hạt khí truyền vào vật chứa trong vụ va chạm này là sự thay đổi động lượng của hạt.[8] Trong một vụ va chạm chỉ có thành phần thông thường của vận tốc thay đổi. Một hạt chuyển động song song với bức tường không thay đổi động lượng của nó. Do đó, lực trung bình trên một bề mặt phải là sự thay đổi trung bình của động lượng tuyến tính từ tất cả các vụ va chạm của các hạt khí này.
Áp suất là tổng của tất cả các thành phần thông thường của lực do các phần tử tác động vào thành bình chia cho diện tích bề mặt của thành bình.
Nhiệt độ
Ký hiệu được sử dụng để biểu diễn nhiệt độ trong phương trình là T với đơn vị SI là kelvins.
Tốc độ của một hạt khí tỷ lệ với nhiệt độ tuyệt đối của nó. Thể tích của quả bóng trong video sẽ thu nhỏ lại khi các hạt khí bị mắc kẹt chậm lại với việc bổ sung nitơ cực lạnh. Nhiệt độ của bất kỳ hệ thống vật chất nào đều liên quan đến chuyển động của các hạt (phân tử và nguyên tử) tạo nên hệ [khí].[9] Trong cơ học thống kê, nhiệt độ là thước đo của động năng trung bình được lưu trữ trong một hạt. Các phương pháp lưu trữ năng lượng này được quy định bởi bậc tự do của chính hạt (chế độ năng lượng). Động năng được thêm vào (quá trình thu nhiệt) cho các hạt khí bằng cách va chạm tạo ra chuyển động thẳng, quay và dao động. Ngược lại, một phân tử trong chất rắn chỉ có thể tăng phương thức dao động của nó khi có thêm nhiệt vì cấu trúc tinh thể mạng ngăn cản cả chuyển động thẳng và chuyển động quay. Các phân tử khí được đốt nóng này có một phạm vi tốc độ lớn hơn, liên tục thay đổi do va chạm liên tục với các hạt khác. Phạm vi tốc độ có thể được mô tả bằng phân bố Maxwell – Boltzmann. Việc sử dụng sự phân bố này ngụ ý rằng khí lý tưởng gần cân bằng nhiệt động lực học cho hệ thống các hạt đang được xem xét.
Thể tích riêng
Ký hiệu được sử dụng để biểu thị thể tích riêng trong phương trình là "v" với đơn vị SI là mét khối trên kilogam.
Ký hiệu được sử dụng để biểu diễn thể tích trong phương trình là "V" với đơn vị SI là mét khối.
Khi thực hiện một phân tích nhiệt động lực học, người ta thường nói đến các tính chất chuyên sâu và mở rộng. Các thuộc tính phụ thuộc vào lượng khí (theo khối lượng hoặc thể tích) được gọi là thuộc tính mở rộng, trong khi các thuộc tính không phụ thuộc vào lượng khí được gọi là thuộc tính thâm dụng. Thể tích cụ thể là một ví dụ về tính chất chuyên sâu vì nó là tỷ số thể tích chiếm bởi một đơn vị khối lượng của một chất khí giống nhau trong toàn hệ thống ở trạng thái cân bằng.[10] 1000 nguyên tử một chất khí chiếm cùng một không gian với bất kỳ 1000 nguyên tử nào khác ở mọi nhiệt độ và áp suất nhất định. Khái niệm này dễ hình dung hơn đối với các chất rắn như sắt không thể nén được so với chất khí. Tuy nhiên, bản thân thể tích --- không cụ thể --- là một thuộc tính mở rộng.
Mật độ / khối lượng riêng
Ký hiệu được sử dụng để biểu thị mật độ trong phương trình là ρ (rho) với đơn vị SI là kilogam trên mét khối. Thuật ngữ này là nghịch đảo của thể tích riêng.
Vì các phân tử khí có thể di chuyển tự do trong một bình chứa, khối lượng của chúng thường được đặc trưng bởi mật độ. Khối lượng riêng là lượng khối lượng trên một đơn vị thể tích của một chất, hoặc nghịch đảo của khối lượng riêng. Đối với chất khí, mật độ có thể thay đổi trong một phạm vi rộng vì các hạt tự do di chuyển lại gần nhau hơn khi bị hạn chế bởi áp suất hoặc thể tích. Sự thay đổi mật độ này được gọi là khả năng nén. Giống như áp suất và nhiệt độ, tỷ trọng là một biến trạng thái của chất khí và sự thay đổi tỷ trọng trong bất kỳ quá trình nào cũng bị chi phối bởi các định luật nhiệt động lực học. Đối với khí tĩnh, tỷ trọng là như nhau trong toàn bộ bình chứa. Mật độ do đó là một đại lượng vô hướng. Có thể chỉ ra bằng thuyết động học rằng khối lượng riêng tỷ lệ nghịch với kích thước của bình chứa trong đó một khối khí cố định bị giam giữ. Trong trường hợp này là một khối lượng cố định, khối lượng riêng giảm khi khối lượng tăng.
Quy mô vi mô
Nếu người ta có thể quan sát một chất khí dưới kính hiển vi mạnh, người ta sẽ thấy một tập hợp các hạt (phân tử, nguyên tử, ion, electron, v.v.) không có bất kỳ hình dạng hoặc thể tích xác định nào đang chuyển động ngẫu nhiên ít nhiều. Các hạt khí trung hòa này chỉ đổi hướng khi chúng va chạm với một hạt khác hoặc với các mặt của vật chứa. Trong chất khí lý tưởng, các va chạm này có tính đàn hồi hoàn hảo. Hình ảnh hạt hoặc hình ảnh vi mô này của một chất khí được mô tả bởi lý thuyết động học-phân tử. Các giả định đằng sau lý thuyết này có thể được tìm thấy trong phần định đề của lý thuyết động học.
Lý thuyết động học
Lý thuyết động học cung cấp cái nhìn sâu sắc về các tính chất vĩ mô của chất khí bằng cách xem xét thành phần phân tử và chuyển động của chúng. Bắt đầu với các định nghĩa về động lượng và động năng,[11] người ta có thể sử dụng bảo toàn động lượng và các mối quan hệ hình học của một khối lập phương để liên hệ các tính chất hệ vĩ mô của nhiệt độ và áp suất với tính chất vi mô của động năng trên mỗi phân tử. Lý thuyết động học cung cấp các giá trị trung bình cho hai thuộc tính này.
Lý thuyết cũng giải thích cách hệ thống khí phản ứng với sự thay đổi. Ví dụ, khi một chất khí được đốt nóng từ độ không tuyệt đối, khi nó (theo lý thuyết) đứng yên hoàn toàn, nội năng (nhiệt độ) của nó tăng lên. Khi một chất khí bị đốt nóng, các hạt sẽ tăng tốc độ và nhiệt độ của nó tăng lên. Điều này dẫn đến số lượng va chạm lớn hơn với vật chứa trên một đơn vị thời gian do tốc độ hạt cao hơn liên quan đến nhiệt độ cao. Áp suất tăng tương ứng với số lần va chạm trên một đơn vị thời gian.
Chuyển động Brown

Chuyển động Brown là mô hình toán học được sử dụng để mô tả chuyển động ngẫu nhiên của các hạt lơ lửng trong chất lỏng. Hoạt ảnh hạt khí, sử dụng các hạt màu hồng và xanh lá cây, minh họa hành vi này dẫn đến sự lan truyền ra các chất khí (entropy). Những sự kiện này cũng được mô tả bằng lý thuyết hạt.
Vì việc quan sát các hạt khí riêng lẻ (nguyên tử hoặc phân tử) đang ở giới hạn (hoặc xa hơn) công nghệ hiện tại, nên chỉ các tính toán lý thuyết mới đưa ra gợi ý về cách chúng chuyển động, nhưng chuyển động của chúng khác với chuyển động Brown vì chuyển động Brown liên quan đến lực cản trơn do trước lực ma sát của nhiều phân tử khí, bị đâm thủng do va chạm mạnh của một (hoặc một số) phân tử khí riêng lẻ với hạt. Do đó, hạt (thường bao gồm hàng triệu hoặc hàng tỷ nguyên tử) chuyển động theo đường răng cưa, nhưng không quá răng cưa như mong đợi nếu một phân tử khí riêng lẻ được kiểm tra.
Lực giữa các phân tử
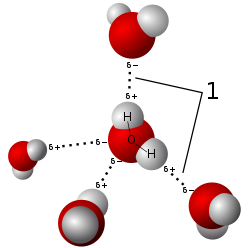
Như đã thảo luận trước đó, lực hút tạm thời (hoặc lực đẩy) giữa các hạt có ảnh hưởng đến động lực học chất khí. Trong hóa lý, tên được đặt cho các lực liên phân tử này là lực van der Waals. Các lực này đóng một vai trò quan trọng trong việc xác định các đặc tính vật lý của chất khí như độ nhớt và tốc độ dòng chảy (xem phần đặc tính vật lý). Bỏ qua các lực này trong những điều kiện nhất định cho phép một khí thực được coi như khí lý tưởng. Giả thiết này cho phép sử dụng các định luật khí lý tưởng giúp đơn giản hóa việc tính toán.
Việc sử dụng hợp lý các mối quan hệ khí này đòi hỏi phải có lý thuyết động học-phân tử (KMT). Khi các hạt khí chịu lực giữa các phân tử, chúng dần dần ảnh hưởng lẫn nhau khi khoảng cách giữa chúng bị giảm đi (mô hình liên kết hydro minh họa một ví dụ). Trong trường hợp không có điện tích, tại một thời điểm nào đó khi khoảng cách giữa các hạt khí giảm đi đáng kể, chúng không còn có thể tránh được va chạm giữa chúng ở nhiệt độ khí bình thường. Một trường hợp khác đối với sự gia tăng va chạm giữa các hạt khí sẽ bao gồm một thể tích khí cố định, khi nung nóng sẽ chứa các hạt vận tốc cao. Điều này có nghĩa là các phương trình lý tưởng này cung cấp các kết quả hợp lý ngoại trừ các điều kiện áp suất cực cao (có thể nén) hoặc nhiệt độ cao (bị ion hóa). Tất cả các điều kiện ngoại trừ này cho phép truyền năng lượng diễn ra trong hệ thống khí. Sự vắng mặt của các chuyển giao bên trong này được gọi là điều kiện lý tưởng trong đó sự trao đổi năng lượng chỉ xảy ra ở các ranh giới của hệ thống. Khí thực trải qua một số va chạm và lực giữa các phân tử. Khi những va chạm này là không đáng kể về mặt thống kê (không thể nén được), kết quả từ các phương trình lý tưởng này vẫn có ý nghĩa. Nếu các hạt khí bị nén lại gần nhau, chúng sẽ hoạt động giống chất lỏng hơn (xem động lực học chất lỏng).
Mô hình đơn giản hóa
Phương trình trạng thái (đối với chất khí) là một mô hình toán học được sử dụng để mô tả hoặc dự đoán gần đúng các đặc tính trạng thái của chất khí. Hiện nay, không có một phương trình trạng thái nào dự đoán chính xác các tính chất của tất cả các chất khí trong mọi điều kiện. Do đó, một số phương trình trạng thái chính xác hơn nhiều đã được phát triển cho các chất khí ở các dải nhiệt độ và áp suất cụ thể. Các "mẫu khí" được bàn luận nhiều nhất là "khí hoàn hảo", "khí lý tưởng" và "khí thực". Mỗi mô hình này có một tập hợp các giả thiết riêng để tạo điều kiện thuận lợi cho việc phân tích một hệ thống nhiệt động lực học nhất định.[12] Mỗi mô hình kế tiếp sẽ mở rộng phạm vi bao phủ nhiệt độ mà nó áp dụng.
Mô hình khí lý tưởng và khí hoàn hảo
Phương trình trạng thái của khí lý tưởng hoặc khí hoàn hảo là định luật khí lý tưởng:
trong đó P là áp suất, V là thể tích, n là lượng khí (tính theo đơn vị mol), R là hằng số khí phổ quát, 8.314 J / (mol K), và T là nhiệt độ. Được viết theo cách này, nó đôi khi được gọi là "phiên bản của nhà hóa học", vì nó nhấn mạnh số phân tử n. Nó cũng có thể được viết là
trong đó là hằng số khí cụ thể đối với một khí cụ thể, tính bằng đơn vị J / (kg K), và ρ = m / V là mật độ. Ký hiệu này là phiên bản "động lực học khí", thực tế hơn trong việc mô hình hóa các dòng khí liên quan đến gia tốc mà không có phản ứng hóa học.
Định luật khí lý tưởng không đưa ra giả thiết về nhiệt dung riêng của chất khí. Trong trường hợp chung nhất, nhiệt dung riêng là hàm của cả nhiệt độ và áp suất. Nếu bỏ qua sự phụ thuộc áp suất (và có thể cả sự phụ thuộc vào nhiệt độ) trong một ứng dụng cụ thể, đôi khi chất khí được cho là một chất khí hoàn hảo, mặc dù các giả thiết chính xác có thể khác nhau tùy thuộc vào tác giả và/hoặc lĩnh vực khoa học.
Đối với khí lý tưởng, định luật khí lý tưởng được áp dụng không giới hạn nhiệt dung riêng. Khí lý tưởng là một "khí thực" được đơn giản hóa với giả thiết rằng hệ số nén Z được đặt bằng 1 nghĩa là tỷ số khí nén này không đổi. Hệ số nén của một cũng yêu cầu bốn biến trạng thái tuân theo định luật khí lý tưởng.
Sự xấp xỉ này phù hợp hơn cho các ứng dụng trong kỹ thuật mặc dù các mô hình đơn giản hơn có thể được sử dụng để tạo ra phạm vi "ball-park" về vị trí của giải pháp thực sự. Một ví dụ trong đó "ước lượng khí lý tưởng" sẽ phù hợp là bên trong buồng đốt của động cơ phản lực.[13] Nó cũng có thể hữu ích để giữ các phản ứng cơ bản và sự phân ly hóa học để tính toán lượng khí thải.
Khí thực

Mỗi một trong số các giả định được liệt kê dưới đây sẽ làm tăng thêm độ phức tạp của giải pháp cho vấn đề. Khi mật độ của một chất khí tăng lên cùng với áp suất tăng, các lực giữa các phân tử đóng một vai trò quan trọng hơn trong hành vi của chất khí, dẫn đến định luật khí lý tưởng không còn cung cấp các kết quả "hợp lý". Ở phần cuối trên của dải nhiệt độ động cơ (ví dụ phần đốt cháy - 1300 K), các phần tử nhiên liệu phức tạp hấp thụ năng lượng bên trong bằng các chuyển động quay và dao động làm cho nhiệt dung riêng của chúng thay đổi so với các phân tử khí gồm hai nguyên tử và khí trơ. Ở nhiệt độ cao hơn gấp đôi nhiệt độ đó, sự kích thích và phân ly điện tử của các hạt khí bắt đầu xảy ra khiến áp suất điều chỉnh thành số lượng hạt lớn hơn (chuyển từ khí sang plasma).[14] Cuối cùng, tất cả các quá trình nhiệt động lực học được cho là mô tả các chất khí đồng nhất có vận tốc thay đổi theo một phân bố cố định. Sử dụng tình huống không cân bằng ngụ ý trường dòng chảy phải được đặc trưng theo một cách nào đó để tạo ra giải pháp. Một trong những nỗ lực đầu tiên để mở rộng ranh giới của định luật khí lý tưởng là bao gồm phạm vi bảo hiểm cho các quá trình nhiệt động lực học khác nhau bằng cách điều chỉnh phương trình để đọc pV n = hằng số và sau đó thay đổi n thông qua các giá trị khác nhau, chẳng hạn như tỷ nhiệt riêng, γ.
Hiệu ứng khí thực bao gồm những điều chỉnh được thực hiện để giải thích cho một loạt các hành vi của chất khí:
- Hiệu ứng nén (Z được phép thay đổi từ 1,0)
- Nhiệt dung thay đổi (nhiệt cụ thể thay đổi theo nhiệt độ)
- Lực Van der Waals (liên quan đến khả năng nén, có thể thay thế các phương trình trạng thái khác)
- Hiệu ứng nhiệt động không cân bằng
- Các vấn đề về sự phân ly phân tử và các phản ứng cơ bản với thành phần biến đổi.
Đối với hầu hết các ứng dụng, một phân tích chi tiết như vậy là quá mức. Các ví dụ mà hiệu ứng khí thực sẽ có tác động đáng kể đến việc tái nhập cảnh của Tàu con thoi khi có nhiệt độ và áp suất cực cao hoặc các khí sinh ra trong các sự kiện địa chất như trong hình ảnh vụ phun trào năm 1990 của Núi Redoubt.
Nghiên cứu trong lịch sử
Định luật Boyle

Định luật Boyle có lẽ là biểu thức đầu tiên của một phương trình trạng thái. Năm 1662 Robert Boyle đã thực hiện một loạt thí nghiệm sử dụng một ống thủy tinh hình chữ J, được bịt kín ở một đầu. Thủy ngân được thêm vào ống, giữ một lượng không khí cố định trong đầu ngắn, bịt kín của ống. Sau đó, người ta đo cẩn thận thể tích khí khi thêm thủy ngân vào ống. Áp suất của khí có thể được xác định bằng sự chênh lệch giữa mức thủy ngân ở đầu ống ngắn và mức thủy ngân ở đầu dài, hở. Hình ảnh về thiết bị của Boyle cho thấy một số công cụ kỳ lạ được Boyle sử dụng trong quá trình nghiên cứu về chất khí.
Thông qua các thí nghiệm này, Boyle nhận thấy rằng áp suất do một chất khí giữ ở nhiệt độ không đổi tác dụng lên tỷ lệ nghịch với thể tích của chất khí đó.[15] Ví dụ, nếu thể tích giảm một nửa, áp suất tăng gấp đôi; và nếu tăng thể tích lên gấp đôi thì áp suất giảm đi một nửa. Với mối quan hệ nghịch đảo giữa áp suất và thể tích, tích của áp suất (P) và thể tích (V) là một hằng số (k) đối với một khối lượng khí giam nhất định miễn là nhiệt độ không đổi, và được nêu dưới dạng công thức như sau:
Vì thể tích và áp suất trước và sau của một lượng khí cố định, trong đó nhiệt độ trước và sau như nhau, đều bằng hằng số k nên chúng có thể liên hệ với nhau theo phương trình:
Định luật Charles
Năm 1787, nhà vật lý học người Pháp và người tiên phong về khinh khí cầu, Jacques Charles, phát hiện ra rằng oxy, nitơ, hydro, carbon dioxide và không khí giãn nở ở cùng một mức độ trong cùng một khoảng 80 kelvin. Ông lưu ý rằng, đối với một khí lý tưởng ở áp suất không đổi, thể tích tỷ lệ thuận với nhiệt độ của nó:
Định luật Gay-Lussac
Năm 1802, Joseph Louis Gay-Lussac công bố kết quả của các thí nghiệm tương tự, mặc dù quy mô hơn.[16] Gay-Lussac ghi nhận công trình trước đó của Charles bằng cách đặt tên cho luật để vinh danh ông. Bản thân Gay-Lussac được ghi nhận với định luật mô tả áp lực, mà ông đã tìm ra vào năm 1809. Nó chỉ ra rằng áp suất do khí lý tưởng tác dụng lên các mặt của bình chứa tỷ lệ với nhiệt độ của nó.
Định luật Avogadro
Năm 1811, Amedeo Avogadro đã xác minh rằng các thể tích khí tinh khiết bằng nhau chứa cùng một số hạt. Lý thuyết của ông thường không được chấp nhận cho đến năm 1858 khi một nhà hóa học người Ý khác là Stanislao Cannizzaro có thể giải thích các ngoại lệ không lý tưởng. Đối với công trình nghiên cứu của ông về khí một thế kỷ trước, con số mang tên ông hằng số Avogadro đại diện cho số nguyên tử được tìm thấy trong 12 gam cacbon nguyên tố-12 (6,022 × 10 23 mol −1). Số hạt khí cụ thể này, ở nhiệt độ và áp suất tiêu chuẩn (định luật khí lý tưởng) chiếm 22,40 lít, được gọi là thể tích mol.
Định luật Avogadro phát biểu rằng thể tích chiếm của một khí lý tưởng tỷ lệ với số mol (hoặc phân tử) có trong bình chứa. Điều này dẫn đến thể tích mol của một khí, ở STP là 22,4 dm 3 (hoặc lít). Mối quan hệ được đưa ra bởi phương trình
trong đó n bằng số mol khí (số phân tử chia cho số Avogadro).
Định luật Dalton

Năm 1801, John Dalton công bố định luật về áp suất riêng phần từ công trình của mình với mối quan hệ của định luật khí lý tưởng: Áp suất của một hỗn hợp khí không phản ứng bằng tổng áp suất của tất cả các khí thành phần. Về mặt toán học, điều này có thể được biểu diễn cho n khí là:
Pressuretotal = Pressure1 + Pressure2 +... + Pressuren
Hình ảnh trong nhật ký của Dalton mô tả ký hiệu mà ông sử dụng như tốc ký để ghi lại con đường mà ông đã đi theo. Trong số các quan sát trên tạp chí quan trọng của ông khi trộn "chất lỏng đàn hồi" (khí) không phản ứng như sau:[17]
- Không giống như chất lỏng, khí nặng hơn không trôi xuống đáy khi trộn lẫn.
- Nhận dạng hạt khí không đóng vai trò gì trong việc xác định áp suất cuối cùng (chúng hoạt động như thể kích thước của chúng không đáng kể).
Những chủ đề đặc biệt
Tính nén được

Các nhà nhiệt động học sử dụng hệ số này (Z) để thay đổi phương trình khí lý tưởng nhằm tính đến hiệu ứng nén của khí thực. Yếu tố này đại diện cho tỷ lệ giữa khối lượng thực tế và lý tưởng. Nó đôi khi được gọi là "yếu tố sai lệch" hoặc hiệu chỉnh để mở rộng phạm vi hữu ích của định luật khí lý tưởng cho các mục đích thiết kế. Thông thường giá trị Z này rất gần với sự thống nhất. Hình ảnh hệ số nén minh họa Z thay đổi như thế nào trong một phạm vi nhiệt độ rất lạnh.
Số Reynolds
Trong cơ học chất lỏng, số Reynolds là tỷ số giữa lực quán tính (vsρ) và lực nhớt (μ/L). Nó là một trong những số không thứ nguyên quan trọng nhất trong động lực học chất lỏng và được sử dụng, thường cùng với các số không thứ nguyên khác, để cung cấp tiêu chí xác định độ tương tự động. Như vậy, số Reynolds cung cấp mối liên hệ giữa kết quả mô hình hóa (thiết kế) và các điều kiện thực tế ở quy mô đầy đủ. Nó cũng có thể được sử dụng để mô tả dòng chảy.
Độ nhớt

Độ nhớt, một tính chất vật lý, là thước đo mức độ dính của các phân tử liền kề với nhau. Vật rắn có thể chịu được lực cắt do sức mạnh của các lực liên phân tử dính này. Một chất lỏng sẽ liên tục biến dạng khi chịu một tải trọng tương tự. Trong khi chất khí có giá trị độ nhớt thấp hơn chất lỏng, nó vẫn là một đặc tính quan sát được. Nếu các chất khí không có độ nhớt, thì chúng sẽ không dính vào bề mặt của cánh và tạo thành một lớp ranh giới. Một nghiên cứu về cánh đồng bằng trong hình ảnh Schlieren cho thấy rằng các hạt khí dính vào nhau (xem phần Lớp ranh giới).
Sự hỗn loạn

Trong động lực học chất lỏng, dòng chảy rối hay dòng chảy rối là một chế độ dòng chảy được đặc trưng bởi những thay đổi hỗn loạn, đặc tính ngẫu nhiên. Điều này bao gồm khuếch tán xung lượng thấp, đối lưu động lượng cao, và sự biến đổi nhanh chóng của áp suất và vận tốc trong không gian và thời gian. Chế độ xem vệ tinh về thời tiết xung quanh Quần đảo Robinson Crusoe là một ví dụ.
Lớp ranh giới
Trên thực tế, các hạt sẽ "dính" vào bề mặt của một vật thể chuyển động qua nó. Lớp hạt này được gọi là lớp biên hay lớp ranh giới. Ở bề mặt của vật, bản chất là tĩnh do bề mặt ma sát. Đối tượng, với lớp ranh giới của nó thực sự là hình dạng mới của đối tượng mà phần còn lại của các phân tử "nhìn thấy" khi đối tượng tiếp cận. Lớp ranh giới này có thể tách khỏi bề mặt, về cơ bản là tạo ra một bề mặt mới và thay đổi hoàn toàn đường dẫn dòng chảy. Ví dụ cổ điển về điều này là một chiếc airfoil bị đình trệ. Hình ảnh cánh đồng bằng cho thấy rõ lớp ranh giới dày lên khi khí chảy từ phải sang trái dọc theo mép dẫn đầu.
Nguyên tắc entropy cực đại
Khi tổng số bậc tự do tiến tới vô cùng, hệ thống sẽ được tìm thấy trong trạng thái vĩ mô tương ứng với tính đa bội cao nhất. Để minh họa nguyên tắc này, hãy quan sát nhiệt độ da của một thanh kim loại đông lạnh. Sử dụng hình ảnh nhiệt của nhiệt độ da, lưu ý sự phân bố nhiệt độ trên bề mặt. Quan sát ban đầu về nhiệt độ này đại diện cho một " vi hạt ". Vào một thời điểm nào đó trong tương lai, lần quan sát thứ hai về nhiệt độ da sẽ tạo ra một vi hạt thứ hai. Bằng cách tiếp tục quá trình quan sát này, có thể tạo ra một loạt các vi hạt minh họa lịch sử nhiệt của bề mặt thanh. Có thể mô tả đặc điểm của chuỗi vi mô trong lịch sử này bằng cách chọn trạng thái vĩ mô phân loại thành công tất cả chúng thành một nhóm duy nhất.
Cân bằng nhiệt động lực học
Khi sự truyền năng lượng ngừng lại từ một hệ thống, điều kiện này được gọi là cân bằng nhiệt động lực học. Thông thường, điều kiện này có nghĩa là hệ thống và môi trường xung quanh có cùng nhiệt độ để nhiệt không còn truyền giữa chúng. Nó cũng ngụ ý rằng các lực bên ngoài là cân bằng (thể tích không thay đổi) và tất cả các phản ứng hóa học trong hệ thống đều hoàn thành. Tiến trình thay đổi cho các sự kiện này tùy thuộc vào hệ thống được đề cập. Một thùng chứa nước đá được phép tan chảy ở nhiệt độ phòng phải mất hàng giờ, trong khi trong chất bán dẫn, sự truyền nhiệt xảy ra trong quá trình chuyển đổi thiết bị từ trạng thái bật sang trạng thái tắt có thể theo thứ tự vài nano giây.
Xem thêm
Tham khảo
- ^ This early 20th century discussion infers what is regarded as the plasma state. See page 137 of American Chemical Society, Faraday Society, Chemical Society (Great Britain) The Journal of Physical Chemistry, Volume 11 Cornell (1907).
- ^ The work by T. Zelevinski provides another link to recent research about strontium in this new field of study. See Tanya Zelevinsky (2009). "84Sr—just right for forming a Bose-Einstein condensate". Physics. Quyển 2. tr. 94. Bibcode:2009PhyOJ...2...94Z. doi:10.1103/physics.2.94.
- ^ For the Bose–Einstein condensate see Quantum Gas Microscope Offers Glimpse Of Quirky Ultracold Atoms. ScienceDaily. ngày 4 tháng 11 năm 2009.
- ^ The authors make the connection between molecular forces of metals and their corresponding physical properties. By extension, this concept would apply to gases as well, though not universally. Cornell (1907) pp. 164–5.
- ^ One noticeable exception to this physical property connection is conductivity which varies depending on the state of matter (ionic compounds in water) as described by Michael Faraday in 1833 when he noted that ice does not conduct a current. See page 45 of John Tyndall's Faraday as a Discoverer (1868).
- ^ John S. Hutchinson (2008). Concept Development Studies in Chemistry. tr. 67.
- ^ Anderson, p.501
- ^ J. Clerk Maxwell (1904). Theory of Heat. Mineola: Dover Publications. tr. 319–20. ISBN 978-0-486-41735-6.
- ^ See pages 137–8 of Society, Cornell (1907).
- ^ Kenneth Wark (1977). Thermodynamics (ấn bản thứ 3). McGraw-Hill. tr. 12. ISBN 978-0-07-068280-1.
- ^ For assumptions of kinetic theory see McPherson, pp.60–61
- ^ Anderson, pp. 289–291
- ^ John, p.205
- ^ John, pp. 247–56
- ^ McPherson, pp.52–55
- ^ McPherson, pp.55–60
- ^ John P. Millington (1906). John Dalton. tr. 72, 77–78.
- John D. Anderson. Modern Compressible Flow: Third Edition New York, NY: McGraw-Hill, 2004. ISBN 0-07-124136-1
- Philip Hill and Carl Peterson. Mechanics and Thermodynamics of Propulsion: Second Edition Addison-Wesley, 1992. ISBN 0-201-14659-2
- John D. Anderson. Fundamentals of Aerodynamics: Fourth Edition New York, NY: McGraw-Hill, 2007. ISBN 978-0-07-295046-5 ISBN 0-07-295046-3
- National Aeronautics and Space Administration (NASA). Animated Gas Lab. Truy cập February, 2008.
- Georgia State University. HyperPhysics. Truy cập February, 2008.
- Antony Lewis WordWeb. Truy cập February, 2008.
- Northwestern Michigan College The Gaseous State. Truy cập February, 2008.

















