
| |
| |
| Danh pháp | |
|---|---|
| IUPAC
Nitrosyl fluoride[citation needed]
| |
| Danh pháp khác
Nitơ oxiforua[citation needed]
| |
| Identifiers | |
Số CAS
|
|
3D model (JSmol)
|
|
| Viết tắt | NOF[citation needed] |
| ChemSpider | |
| ECHA InfoCard | 100.029.230 |
| EC Number | 232-153-6 |
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|
| |
| Tính chất | |
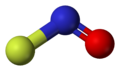
| Công thức hóa học | NOF |
| Phân tử khối | 49.0045 g mol−1 |
| Hình dạng | Khí không màu |
| Khối lượng riêng | 2.657 mg mL−1 |
| Điểm nóng chảy | −166 °C (−267 °F; 107 K) |
| Điểm sôi | −72.4 °C (−98.3 °F; 200.8 K) |
Tính tan trong nước
|
Phản ứng |
| Hợp chất liên quan | |
| Hợp chất liên quan | |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
Nitrosyl fluoride (NOF) là hợp chất nitroso có liên kết cộng hóa trị.
Phản ứng
NOF là tác nhân flo hóa mạnh, phản ứng với nhiều kim loại để tạo thành muối fluoride, giải phóng nitơ monoxit theo quá trình:
- n NOF + M → MFn + n NO
NOF cũng fluoride hóa muối fluoride tạo thành các sản phẩm cộng có đặc tính giống như muối, như NOBF4.
Dung dịch NOF trong nước hòa tan mạnh kim loại, theo cơ chế tương tự như nước vương thủy. Nitrosyl fluoride phản ứng với nước tạo thành axit nitrơ, sau đó tạo thành axit nitric:
- NOF + H2O → HNO2 + HF
- 3 HNO2 → HNO3 + 2 NO + H2O
Nitrosyl fluoride phản ứng với alcohol tạo thành nitrit:
- ROH + NOF → RONO + HF
Phân tử có hình dạng uốn cong: điều này đã được chứng minh theo mô hình VSEPR, tại đó cặp electron không liên kết nằm trên nguyên tử N.
Ứng dụng
Nitrosyl fluoride được sử dụng làm dung môi [cần dẫn nguồn] và làm tác nhân flo hóa và nitrat hóa trong tổng hợp hữu cơ. [cần dẫn nguồn] Nitrosyl fluoride từng được đề xuất làm chất oxy hóa trong các động cơ tên lửa.
Tham khảo
Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (bằng tiếng Anh) (ấn bản thứ 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4








